红色诺卡菌细胞壁骨架对中性粒细胞生物学功能的调节作用
杨云稀 黄佳敏 刘璐 李林斌 郑淳方 周于莹 孙炳伟
作者单位:南京医科大学附属苏州医院烧伤整形科,苏州 215002
引用本文:杨云稀, 黄佳敏, 刘璐, 等. 红色诺卡菌细胞壁骨架对中性粒细胞生物学功能的调节作用[J]. 中华烧伤与创面修复杂志. Doi: 10.3760/cma.j.cn501225-20230223-00056.
摘要
目的 探讨红色诺卡菌细胞壁骨架(Nr-CWS)对中性粒细胞生物学功能的调节作用及机制。
方法 采用实验研究方法。2022年5月―10月招募于苏州市体检中心体检的成年健康志愿者15名(男7名、女8名,年龄24~45岁),采集外周静脉血,采用免疫磁珠分选法提取中性粒细胞。将细胞分为不进行任何处理的正常对照组、仅用终质量浓度为60 ng/mL Nr-CWS处理的单纯Nr-CWS组、仅用终质量浓度1 μg/mL内毒素/脂多糖(LPS)刺激的单纯LPS组、用同前LPS刺激后用Nr-CWS处理的LPS+Nr-CWS组。培养2 h,采用改良后的琼脂糖下细胞趋化模型检测中性粒细胞的趋化距离、趋化细胞百分比、趋化指数、最大趋化速度、趋化功能评分。采用流式细胞术检测培养0.5 h发生吞噬的细胞占比与荧光强度,活性氧水平,颗粒蛋白CD35、CD66b、CD63的蛋白表达水平及培养3.5 h细胞培养上清液中炎症因子白细胞介素2(IL-2)、IL-4、IL-6、IL-10、IL-17A、肿瘤坏死因子α(TNF-α)、γ干扰素浓度。以上实验各组样本数均为15。对数据行析因设计方差分析与独立样本t检验。
结果 培养2 h,与正常对照组比较,单纯LPS组与LPS+Nr-CWS组细胞趋化距离、趋化细胞百分比、趋化指数、最大趋化速度与趋化功能评分均显著降低(t值分别为18.36、18.88、54.28、18.36、46.77,10.58、14.74、6.84、10.58、4.24,P<0.05);与单纯LPS组比较,LPS+Nr-CWS组细胞上述5项趋化功能指标均显著升高(t值分别为11.47、14.65、11.62、11.47、13.75,P<0.05)。培养0.5 h,与正常对照组比较,单纯Nr-CWS组发生吞噬的细胞占比与荧光强度均显著升高(t值分别为6.86、6.73,P<0.05),单纯LPS组与LPS+Nr-CWS组发生吞噬的细胞占比(t值分别为7.35、22.72,P<0.05)与荧光强度(t值分别为21.37、13.10,P<0.05)均明显降低。培养0.5 h,与正常对照组比较,单纯LPS组细胞活性氧水平显著增加(t=6.64,P<0.05);与单纯LPS组比较,LPS+Nr-CWS组细胞活性氧水平明显降低(t=5.46,P<0.05)。培养0.5 h,与正常对照组比较,单纯LPS组与LPS+Nr-CWS组细胞CD35、CD66b、CD63蛋白表达均显著升高(t值分别为16.75、17.45、10.82,5.70、19.35、15.37,P<0.05);与单纯LPS组比较,LPS+Nr-CWS组细胞CD35、CD66b、CD63蛋白表达均明显下降(t值分别为4.92、5.72、3.18,P<0.05)。培养3.5 h,与正常对照组比较,单纯LPS组细胞培养上清液中IL-2、IL-4、IL-6、IL-10、IL-17A、TNF-α、γ干扰素浓度均显著升高(t值分别为22.10、9.50、7.21、10.22、24.88、8.43、47.48,P<0.05),LPS+Nr-CWS组细胞培养上清液中IL-6、IL-10、IL-17A、TNF-α、γ干扰素浓度均显著上升(t值分别为4.68、5.12、8.02、5.58、7.13,P<0.05);与单纯LPS组比较,LPS+Nr-CWS组细胞培养上清液中上述7种炎症因子浓度均显著降低(t值分别为5.40、2.83、5.80、2.90、5.88、4.88、39.64,P<0.05)。
结论 Nr-CWS能够提高正常状态下中性粒细胞的吞噬能力,改善感染状态下中性粒细胞的趋化功能、活性氧、脱颗粒蛋白以及炎症因子水平,在先天免疫层面通过调控中性粒细胞生物学行为,提高抗感染能力。
关键词:感染;吞噬作用;趋化作用;中性粒细胞;生物学功能;红色诺卡菌细胞壁骨架
中性粒细胞是人体外周血循环中含量最丰富的白细胞(占50%~70%)[1],尽管其被定义为寿命短暂的终末细胞,但依旧被人们公认为是先天免疫系统的哨兵,参与并调节许多疾病,如急性损伤、癌症、自身免疫病和慢性炎症等[2-4]的进程。在这些过程中,中性粒细胞主要通过趋化、吞噬、脱颗粒、中性粒细胞外诱捕网、产生活性氧和分泌细胞因子等行为发挥其生物学功能[5-6],并与其他免疫细胞相互协作,维持机体的稳态[7]。红色诺卡菌细胞壁骨架(nocardia rubra cell wall skeleton, Nr-CWS)是一种从革兰阳性菌红色诺卡菌菌体提取的细胞壁骨架成分,主要由诺卡霉素酸、阿拉伯半乳聚糖、胞壁酸和肽聚糖组成[8],目前被常规用于宫颈糜烂和人乳头瘤病毒感染的治疗[9]。大量研究表明,Nr-CWS能够通过增强体内T淋巴细胞、巨噬细胞和自然杀伤细胞的免疫活性,促进免疫细胞对病原体的吞噬和杀灭,以此上调机体的免疫功能,提高人体抗感染能力[10-12],但Nr-CWS对中性粒细胞的作用尚未被阐述。本研究通过使用Nr-CWS对正常状态和感染状态(LPS刺激)下中性粒细胞进行干预,探讨Nr-CWS对中性粒细胞生物学功能的调节作用及机制。本实验研究经南京医科大学附属苏州医院医学伦理委员会批准(批号:KL906014),所有健康志愿者在采血前均签署了知情同意书。所有实验均按照批准的实验操作指南进行。Nr-CWS购自辽宁格瑞仕特生物制药有限公司,生理盐水购自四川科伦药业股份有限公司,Hank平衡盐溶液(HBSS)、PBS、RPMI-1640培养基、琼脂糖粉末购自美国Gibco公司,胎牛血清购自新西兰Corning公司,中性粒细胞磁珠分选试剂盒购自加拿大Stemcell公司,LPS、趋化肽、异硫氰酸荧光素(FITC)标记的小鼠抗人CD66b单克隆抗体、活性氧探针购自美国Sigma公司,别藻蓝蛋白(APC)标记的兔抗人CD35单克隆抗体、人Th1/Th2液相蛋白微球定量检测试剂盒购自美国BD公司,藻红蛋白标记的小鼠抗人CD63单克隆抗体购自美国Biolegend公司,吞噬功能检测试剂盒购自美国Thermo Fisher Scientific公司。IX72型倒置荧光显微镜购自日本奥林巴斯公司,FACSCanto Ⅱ型流式细胞分析仪购自美国BD公司。2022年5―10月招募于苏州市体检中心体检的成年健康志愿者15名(男7名、女8名,年龄24~45岁)。志愿者既往体健,无重大疾病史,血常规检测中性粒细胞数量在正常值范围。使用含乙二胺四乙酸抗凝采血管收集志愿者外周静脉血(每名10 mL),采血后2 h内,采用免疫磁珠分选法,应用中性粒细胞磁珠分选试剂盒提取外周血中性粒细胞。将10 mL血液与500 μL中性粒细胞分选抗体、500 μL分选磁珠混合,室温孵育5 min。加入10 mL磁珠分选缓冲液,于磁力架上孵育10 min,吸取上清液。于上清液中再次加入500 μL分选磁珠,混合后于磁力架中分选3次,以400×g离心5 min(离心条件下同)后弃去上清液,收集中性粒细胞。在12孔板中,将中性粒细胞以1×106个/mL重新悬浮于含有体积分数10%胎牛血清的RPMI-1640培养基中(每孔1 mL)。将细胞分为正常对照组、单纯Nr-CWS组、单纯LPS组、Nr-CWS+LPS组。正常对照组细胞不进行任何处理;单纯Nr-CWS组细胞用终质量浓度为60 ng/mL的Nr-CWS处理0.5 h;单纯LPS组细胞用终质量浓度为1 μg/mL的LPS处理0.5 h;LPS+Nr-CWS组细胞先用终质量浓度为1 μg/mL的LPS处理0.5 h,再用终质量浓度为60 ng/mL的Nr-CWS处理0.5 h。采用改良后的琼脂糖下细胞趋化模型进行中性粒细胞趋化功能检测并在基于计算机视觉的细胞趋化分析平台(cell chemotaxis analysis platform,CCAP)中进行数据分析。将HBSS(含钙离子、镁离子)和RPMI-1640培养基的混合液,倒入溶化煮沸的琼脂糖溶液中,混匀制成琼脂糖凝胶溶液。使用规格5 mL移液枪取2.7 mL琼脂糖凝胶溶液于直径35 mm培养皿中,室温下冷却至凝固,放置4 ℃冰箱中待用。取3个孔径为3 mm的不锈钢空心管,制成孔间距为2.8 mm的趋化打孔器,垂直于凝胶平面进行打孔,用负压吸引器吸去孔内凝胶与多余的水分,中间孔内加入10 μL趋化物,两侧孔中分别加入10 μL中性粒细胞(细胞浓度为1×107个/mL),随后将整个体系放入37 ℃、含体积分数5%的二氧化碳培养箱中孵育(下同)2 h,于倒置荧光显微镜下放大40倍拍摄趋化图像并上传至CCAP中,输出包括各项趋化功能指标的分析报告。平台中的趋化区域被划分为3个区:趋化距离<800 μm为Ⅰ区,趋化距离800~2 000 μm为Ⅱ区,趋化距离>2 000 μm为Ⅲ区。趋化功能指标包括:(1)趋化距离,即中性粒细胞于琼脂糖趋化模型中趋化2 h到达的最远距离;(2)趋化细胞百分比,即趋化的中性粒细胞数占细胞总数(1×105个)的百分比;(3)趋化指数,即Ⅰ区与Ⅱ区的中性粒细胞数量与细胞总数(1×105个)的比值;(4)最大趋化速度指趋化距离与趋化时间(2 h)的比值;(5)趋化功能评分,即参考文献[13]进行的趋化功能评分。本实验样本数为15。取4组细胞,以每组1×106个接种于12孔板中(下同)。每组加入20 μL荧光标记的大肠杆菌生物颗粒溶液,避光孵育0.5 h,随后将细胞置于冰上终止吞噬,离心后,于流式细胞仪上检测发生吞噬细胞占比与细胞荧光强度。本实验样本数为15。取4组细胞,加入用100 μL RPMI-1640培养基配制的1 nmol流式活性氧探针2,7-二氯荧光素二乙酸酯,避光孵育0.5 h,离心后,采用流式细胞分析仪检测中性粒细胞活性氧水平。本实验样本数为15。取4组细胞,加入APC标记的兔抗人CD35单克隆抗体、FITC标记的小鼠抗人CD66b单克隆抗体、藻红蛋白标记的小鼠抗人CD63单克隆抗体(稀释比均为1∶1 000),避光条件下孵育0.5 h,采用流式细胞分析仪检测中性粒细胞颗粒蛋白CD35、CD66b、CD63蛋白表达水平。本实验样本数为15。取4组细胞,离心后各取上清液50 μL,加入细胞因子IL-2、IL-4、IL-6、IL-10、IL-17A、TNF-α、γ干扰素微球混合液50 μL,室温下避光孵育0.5 h。再次离心后,加入50 μL藻红蛋白荧光素标记的炎症因子检测抗体孵育3 h,采用流式细胞分析仪检测炎症因子的表达水平。本实验样本数为15。采用SPSS 27.0统计软件进行数据处理。所有计量资料数据均符合正态分布且方差齐,以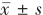 表示,组间总体比较采用析因设计方差分析,组间两两比较采用独立样本t检验。P<0.05为差异有统计学意义。培养2 h,与正常对照组比较,单纯Nr-CWS组细胞5项趋化功能指标,即趋化距离、趋化细胞百分比、趋化指数、最大趋化速度与趋化功能评分均无明显变化(t值分别为0.49、0.38、1.65、0.49、1.73,P>0.05),单纯LPS组与LPS+Nr-CWS组细胞上述5项趋化功能指标均显著降低(t值分别为18.36、18.88、54.28、18.36、46.77,10.58、14.74、6.84、10.58、4.24,P<0.05)。与单纯LPS组比较,LPS+Nr-CWS组细胞上述5项趋化功能指标均显著升高(t值分别为11.47、14.65、11.62、11.47、13.75,P<0.05)。见图1。
表示,组间总体比较采用析因设计方差分析,组间两两比较采用独立样本t检验。P<0.05为差异有统计学意义。培养2 h,与正常对照组比较,单纯Nr-CWS组细胞5项趋化功能指标,即趋化距离、趋化细胞百分比、趋化指数、最大趋化速度与趋化功能评分均无明显变化(t值分别为0.49、0.38、1.65、0.49、1.73,P>0.05),单纯LPS组与LPS+Nr-CWS组细胞上述5项趋化功能指标均显著降低(t值分别为18.36、18.88、54.28、18.36、46.77,10.58、14.74、6.84、10.58、4.24,P<0.05)。与单纯LPS组比较,LPS+Nr-CWS组细胞上述5项趋化功能指标均显著升高(t值分别为11.47、14.65、11.62、11.47、13.75,P<0.05)。见图1。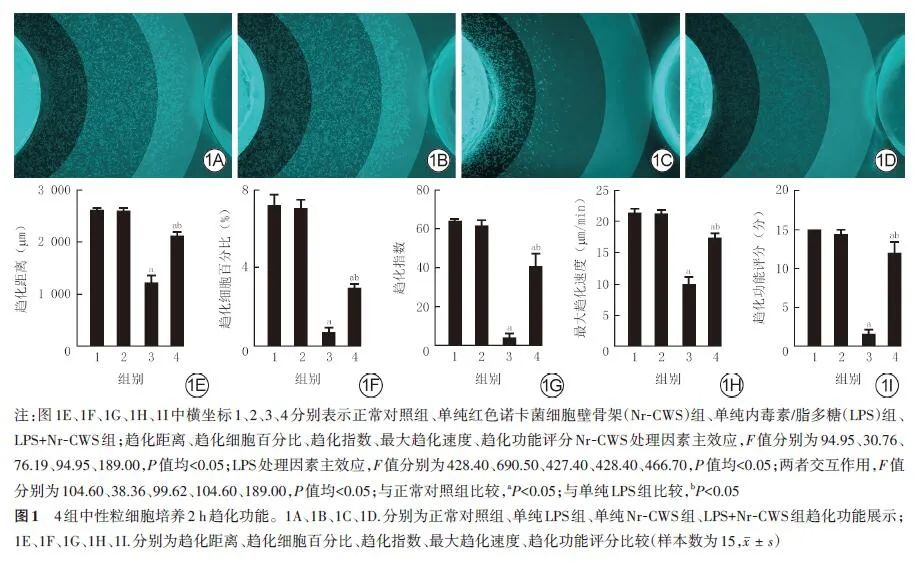
培养0.5 h,与正常对照组比较,单纯Nr-CWS组发生吞噬的细胞占比和荧光强度均显著升高(t值分别为6.86、6.73,P值均为0.001),单纯LPS组与LPS+Nr-CWS组发生吞噬的细胞占比(t值分别为7.35、22.72,P值均<0.001)和荧光强度(t值分别为21.37、13.10,P值均<0.001)均显著降低。与单纯LPS组比较,LPS+Nr-CWS组发生吞噬的细胞占比和荧光强度均无明显变化(t值分别为1.61、2.05,P值分别为0.158、0.087)。见图2。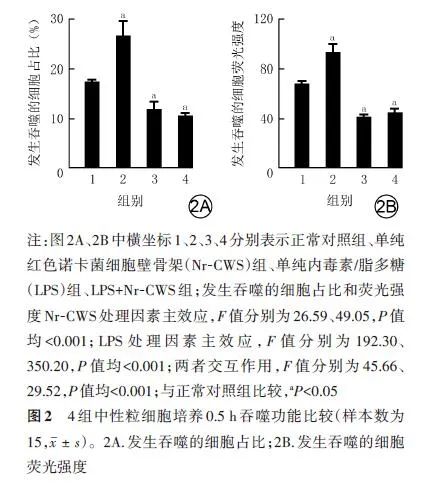
培养0.5 h,与正常对照组比较,单纯LPS组细胞活性氧水平显著升高(t=6.64,P=0.003),单纯Nr-CWS组与LPS+Nr-CWS组细胞活性氧水平均无明显变化(t值分别为0.56、1.30,P值分别为0.603、0.265)。与单纯LPS组比较,LPS+Nr-CWS组细胞活性氧水平明显降低(t=5.46,P=0.006)。见图3。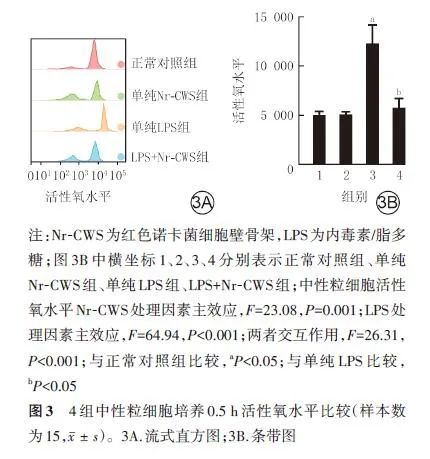
培养0.5 h,与正常对照组比较,单纯Nr-CWS组细胞CD35、CD66b、CD63蛋白表达均无明显变化(t值分别为0.34、1.24、0.85,P<0.05),单纯LPS组与LPS+Nr-CWS组细胞CD35、CD66b、CD63蛋白表达均显著升高(t值分别为16.75、17.45、10.82,5.70、19.35、15.37,P<0.05)。与单纯LPS组比较,LPS+Nr-CWS组细胞CD35、CD66b、CD63蛋白表达均明显下降(t值分别为4.92、5.72、3.18,P<0.05)。见图4。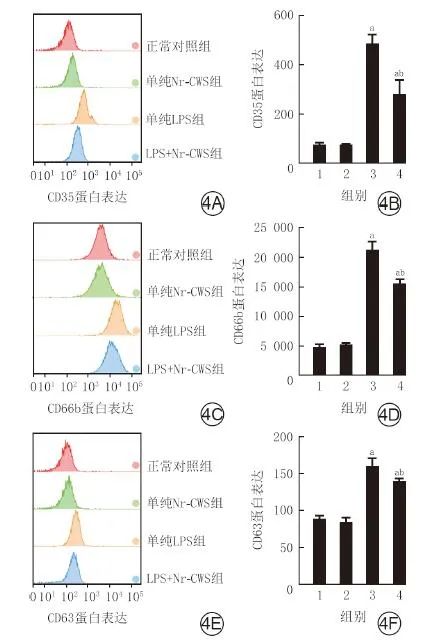
培养3.5 h,与正常对照组比较,单纯Nr-CWS组细胞培养上清液中IL-2、IL-4、IL-6、IL-10、IL-17A、TNF-α、γ干扰素浓度均无明显变化(t值分别为1.59、0.95、2.46、1.82、1.45、2.49、2.27,P>0.05);单纯LPS组细胞培养上清液中上述7种炎症因子浓度均显著升高(t值分别为22.10、9.50、7.21、10.22、24.88、8.43、47.48,P<0.05);LPS+Nr-CWS组细胞培养上清液中IL-6、IL-10、IL-17A、TNF-α、γ干扰素浓度均显著上升(t值分别为4.68、5.12、8.02、5.58、7.13,P<0.05),IL-2、IL-4浓度均无明显变化(t值分别为1.23、1.60,P>0.05)。与单纯LPS组比较,LPS+Nr-CWS组细胞培养上清液中上述7种炎症因子浓度均显著降低(t值分别为5.39、2.83、5.79、2.90、5.88、4.88、39.64,P<0.05)。见图5。
中性粒细胞是感染和组织损伤的主要反应者[14],是一群复杂而功能强大的细胞群体[15]。近期研究表明,中性粒细胞能够通过调控T细胞和B细胞的活化、增殖与分化,参与适应性免疫[16-17]。因此中性粒细胞既是先天免疫反应的效应物,也是适应性免疫反应的指导者[18],在许多疾病的发病机制中扮演重要角色,其生物学功能的正常发挥是人体免疫系统正常运作的保障。本研究通过分离纯化外周血中性粒细胞,对不同干预下的4组细胞,即不进行任何处理的正常对照组、仅用Nr-CWS处理的单纯Nr-CWS组、仅用LPS刺激的单纯LPS组、用LPS+Nr-CWS处理的Nr-CWS+LPS组细胞,采用改良后的琼脂糖下细胞趋化模型检测趋化功能,采用流式细胞术检测细胞吞噬功能、活性氧水平、颗粒(CD35、CD66b、CD63)蛋白表达、7种炎症因子分泌水平。结果显示,在正常状态下,Nr-CWS能够提高中性粒细胞的吞噬能力;而在感染状态下,中性粒细胞的生物学功能发生了一系列的变化,趋化功能明显下降,无法靶向感染部位发挥作用;吞噬功能降低;颗粒蛋白表达增加,并产生大量的活性氧和炎症因子。尽管中性粒细胞脱颗粒增加释放的抗菌蛋白和活性氧均能对消除感染起到一定的作用[19],但是高浓度的抗菌蛋白,如髓过氧化物酶、肝素结合蛋白、基质金属蛋白酶-9等,也能损伤内皮细胞的完整性[20⁃22];且在较高的活性氧水平下,呼吸氧爆发会导致线粒体的破坏,最终对细胞本身及周围组织造成损伤[23]。各种细胞因子水平的升高为炎症因子风暴的产生奠定了基础,是免疫过度的表现,极易对机体造成伤害[24]。对感染状态下中性粒细胞采用Nr-CWS处理后,中性粒细胞趋化功能显著恢复,虽仍未达到正常水平,但各项趋化功能指标均显著上升;细胞的吞噬功能未发生变化,表明Nr-CWS能提高正常状态下中性粒细胞的吞噬能力,却无法逆转感染状态下中性粒细胞的吞噬功能减弱。吞噬功能是中性粒细胞发挥免疫防御和维持机体平衡的重要机制之一,其膜表面广泛表达吞噬受体用以识别病原体,随后受体、配体发生结合,诱导细胞骨架重排,将病原体内化形成吞噬小体,对微生物进行清除[25-26],该结果结合上述趋化功能说明Nr-CWS可能通过增加中性粒细胞的骨架重排,胞膜变化更为灵敏,使细胞变形能力增强而易于发生吞噬行为,但吞噬受体的表达才是吞噬作用得以发挥的决定因素[27]。而感染状态下,中性粒细胞膜表面吞噬受体表达减少,Nr-CWS无法恢复受体的表达,因此不能恢复细胞的吞噬功能。感染状态下行Nr-CWS处理的中性粒细胞活性氧水平恢复正常,颗粒蛋白表达均下降,但仍高于正常状态,表明中性粒细胞可在尽可能不破坏内皮细胞的前提下发挥杀菌功能。炎症因子方面,IL-2、IL-4表达水平均恢复正常,而IL-6、IL-10、IL-17A、TNF-α、γ干扰素水平在Nr-CWS处理后虽然有所下降,但仍高于正常水平。IL-2、IL-6、IL-17A、TNF-α、γ干扰素属于促炎性细胞因子,这些因子水平的下降表明Nr-CWS能够通过调控中性粒细胞对炎症进行控制,该结果与另一针对Nr-CWS对T细胞作用的研究结果[9]一致;IL-10属于抑炎因子,能够调节B细胞、细胞毒性T细胞和Th、自然杀伤细胞、肥大细胞、粒细胞、树突状细胞、KC和内皮细胞的生长和分化,在体内免疫反应和免疫耐受中起着重要作用[28-29],该因子水平在Nr-CWS干预下依旧偏高。而同为抑炎因子的IL-4在Nr-CWS作用下恢复至正常水平。有研究显示,IL-10在哺乳动物中所起的抗炎作用更为强大也更为核心,作用机制更为复杂[30],尽管两者均表现为负调节炎症反应作用,但Nr-CWS对不同因子的作用仍需进一步探讨,对中性粒细胞炎症因子分泌的调控也表现为复杂的双向调控,具体机制尚需进一步研究。综上所述,本研究首次阐述了Nr-CWS对中性粒细胞生物学功能的调节作用,Nr-CWS能够提高正常状态下中性粒细胞的吞噬能力,并改善感染状态下中性粒细胞的趋化功能,降低感染状态下中性粒细胞的活性氧水平、颗粒蛋白表达以及炎症因子水平,提出了Nr-CWS在先天免疫层面能通过调控中性粒细胞生物学行为而发挥抗感染功能的新概念,为Nr-CWS的临床应用提供了更广阔的思路。作者贡献声明
杨云稀:酝酿和设计研究,实施研究,采集、分析、解释数据,撰写论文;黄佳敏、刘璐、李林斌:实施研究,采集数据;郑淳方、周于莹:统计、分析数据;孙炳伟:酝酿和设计研究,对文章内容作批判性审阅,经费支持
 表示,组间总体比较采用析因设计方差分析,组间两两比较采用独立样本t检验。P<0.05为差异有统计学意义。
表示,组间总体比较采用析因设计方差分析,组间两两比较采用独立样本t检验。P<0.05为差异有统计学意义。






