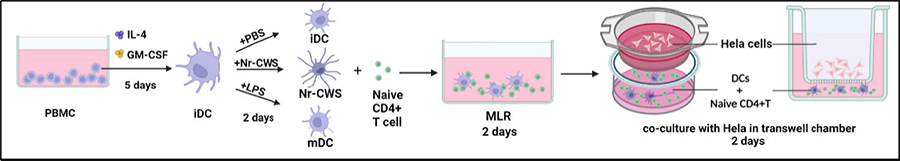
2018年由河北医科大学和红卡®研发团队合作开展一项关于Nr-CWS(红卡®)治疗HPV和CIN的作用机制的研究,2023年3月该研究最新成果《Nocardia rubra cell-wall skeleton activates an immune response in cervical tissue via stimulating FPR3 to enhance dendritic cell-mediated Th1 differentiation》正式在《Frontiers in Immunology》发表,这是继红卡®2021年发布在该期刊上第一篇研究成果《Nocardia Rubra Cell Wall Skeleton Up-Regulates T Cell Subsets and Inhibits PD-1/PD-L1 Pathway to Promote Local Immune Status of Patients With High-Risk Human Papillomavirus Infection and Cervical Intraepithelial Neoplasia》后又一重磅循证依据。

本研究通过体内和体外的大量临床研究,结果表明:
HPV可以通过在局部创造一个免疫抑制的微环境来逃避宿主的免疫监视。根除HPV感染是防止早期病变发展成宫颈癌的最重要的治疗方法。
Nr-CWS对HPV感染和宫颈病变的临床效果可能是由于其对T细胞的免疫激活作用。本研究首次探讨了Nr-CWS对HPV感染患者宫颈组织中CD4+ T细胞亚群的影响,发现Th1免疫反应增强。
由CD4+ T细胞发展而来的Th1细胞对于针对HPV的细胞内杀伤性免疫反应至关重要。研究表明,被HPV感染的宫颈组织的Th1反应较少,在本研究中,Nr-CWS治疗极大地增加了Th1细胞因子IFN-γ的产生,表明Nr-CWS增强了宫颈组织中抗病毒感染的免疫微环境。
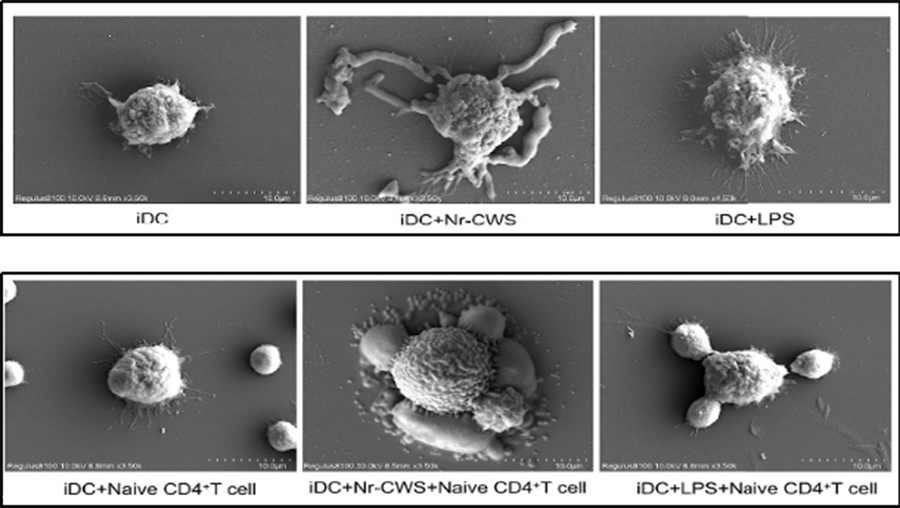
DCs是T细胞免疫的起始触发器。细菌成分、炎症细胞因子或抗原-抗体复合物可以促进DCs的成熟。Nr-CWS是一种源自细菌的提取物,在体外可激活DCs,我们发现由Nr-CWS激活的DC可以诱导Th1分化,其特征是IFN-γ的分泌。据报道,IFN-γ在HeLa细胞中引起程序性死亡,与HeLa细胞的共培养实验也显示了Nr-CWS导致的生长抑制。